体外经过最后一步H2O2孵育6h后
导读
体外经过最后一步H2O2孵育6h后
1.3.4 卵白蛋白消化产物对H2O2诱导的卵白Caco-2细胞内ROS的清除作用
细胞内ROS含量的测定采用文献中报道的DCFH-DA荧光探针法,并稍作修改。蛋白道消细胞孵育以及试验设置同1.3.3.3节,体外经过最后一步H2O2孵育6h后,模拟将96孔板中上清液吸弃,胃肠物用PBS清洗细胞后,化产化活每孔加入20μLDCFH-DA溶液,抗氧放入37℃、性及5%CO2培养箱中孵育20min后,其结用PBS清洗细胞3次后加入DMEM,构表用酶标仪测定其在激发波长485nm、卵白发射波长525nm下的蛋白道消荧光强度。
1.3.5 体外模拟胃肠道消化产物(<1ku)肽序列鉴定
1.3.5.1 肽序列鉴定
利用高效液相色谱-串联质谱对体外模拟胃肠道消化产物(<1ku)进行肽序列鉴定。体外色谱条件:流动相:0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B);流速:300nL/min;洗脱程序:5%~35%B(60min),模拟35%~75%B(4min),胃肠物75%B(10min)。
1.3.5.2 肽的合成
通过高效液相色谱-串联质谱鉴定的肽,委托生工生物工程(上海)股份有限公司合成,纯度达到98%以上。
1.3.6 合成肽的体外抗氧化活性
1.3.6.1 合成肽的ABTS+·清除能力测定
方法同1.3.2.1节。
1.3.6.2 合成肽的ORAC测定
方法同1.3.2.2节。
1.4 数据统计分析
试验结果用平均值±标准差表示,重复3次。用SPSS18.0软件对数据进行显著性分析,P<0.05为有显著性差异。
2 结果与分析
2.1 卵白蛋白及其消化产物的体外抗氧化活性
2.1.1 ABTS+·清除能力测定
蛋白以及蛋白产物的ABTS自由基清除活性结果如图1所示。可以看出,卵白蛋白及其消化产物对ABTS自由基的清除能力均具有浓度依赖性,大小顺序依次为:体外模拟胃肠道消化产物<1ku、体外模拟胃肠道消化产物1~3ku、体外模拟胃肠道消化产物3~10ku、卵白蛋白,说明卵白蛋白经过体外模拟胃肠道消化后,其消化产物的ABTS自由基清除活性均有不同程度的增强,这一结论与文献中已有的报道相符,说明蛋白经过体外模拟胃肠道消化后,产生了新的具有抗氧化活性的肽段或氨基酸。可以发现,分子质量越小的组分表现出越强的ABTS自由基清除活性,其中,分子质量<0.05),最高浓度清除率达49.48%,Foh等以罗非鱼为原料,得到蛋白水解物,同样发现了分子质量<1ku的组分ABTS自由基清除能力最强,与其它组分存在显著性差异(P<0.05),最高浓度清除率达49.48%,Foh等以罗非鱼为原料,得到蛋白水解物,同样发现了分子质量<1ku的组分清除ABTS自由基的能力最强,高于分子质量<3ku的组分和分子质量<5ku的组分。
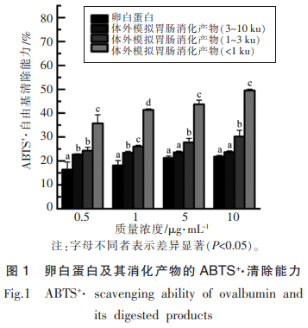
2.1.2 ORAC测定
蛋白以及蛋白产物的氧自由基吸收能力结果如图2所示。ORAC值最大的组分仍然为体外模拟胃肠道消化产物(5ku的组分仍然为体外模拟胃肠道消化产物(<1ku),依次为体外模拟胃肠道消化产物(1~3ku)、体外模拟胃肠道消化产物(5~10ku)、卵白蛋白。其中体外模拟胃肠道消化产物(<1ku)和体外模拟胃肠道消化产物(1~3ku)的ORAC值分别为1.21μg/mLTE/μg/mL和2.07μg/mLTE/μg/mL,高于Trolox的ORAC值(1μg/mLTE/μg/mL)。这一结果与上述结果一致,说明经过体外模拟胃肠道消化,卵白蛋白被酶解,释放出新的抗氧化肽段,抗氧化肽段表现出更强的氧自由基吸收能力,并且分子质量越小的肽段,ORAC值越大。这一结果与文献中已有的报道相符:Vilcacundo等以藜麦蛋白为原料,经过体外模拟胃肠道消化后,分子质量<5ku的组分ORAC值高于分子质量>5ku的组分。

2.2 卵白蛋白及其消化产物的细胞抗氧化活性
2.2.1 H2O2诱导的Caco-2细胞氧化损伤模型的建立
不同浓度的H2O2对Caco-2细胞存活率的影响如图3所示。H2O2容易通过细胞膜,在细胞内产生高活性自由基,从而引发机体氧化应激,最终导致细胞损伤或凋亡。当H2O2浓度由400μmol/L增加到900μmol/L时,细胞存活率逐渐降低,与未经H2O2处理组(对照组)存在显著性差异,当H2O2浓度在700μmol/L时,细胞存活率为48%,约为对照组细胞存活率的50%,当H2O2浓度在900μmol/L时,细胞存活率为13%,细胞氧化损伤过于严重,此时蛋白及其产物难以表现出对细胞的保护作用,综合以上因素,选用700μmol/L的H2O2构建细胞氧化损伤模型,探究体外模拟胃肠道消化的卵白蛋白产物的细胞抗氧化活性。
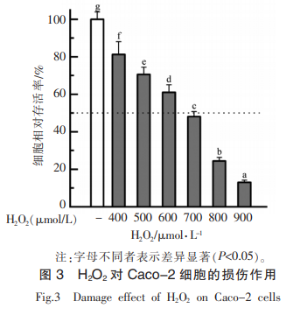
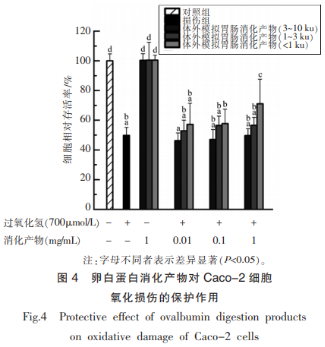
2.2.2 卵白蛋白消化产物对Caco-2细胞氧化损伤的保护作用
卵白蛋白体外模拟胃肠道消化产物对H2O2诱导的细胞氧化应激损伤的保护作用结果如图4所示。按照2.2.1节构建得到的细胞氧化损伤模型,H2O2处理组(损伤组)细胞存活率约为对照组的50%,与对照组存在显著性差异(P<0.05)。在H2O2处理细胞之前,用不同质量浓度的肽(0.01,0.1,1mg/mL)处理细胞,体外模拟胃肠道消化产物(3~10ku)和体外模拟胃肠道消化产物(1~3ku)细胞存活率与损伤组细胞没有显著性差异(P>0.05),对细胞没有氧化损伤的预先保护作用。当体外模拟胃肠道消化产物(<1ku)质量浓度为0.01mg/mL时,细胞存活率与损伤组细胞没有显著性差异(p>0.05),随着产物浓度的升高,细胞存活率逐渐提高,与损伤组存在显著性差异(P<0.05),表明体外模拟胃肠道消化产物(<1ku)对H2O2诱导的细胞氧化应激损伤具有保护作用。值得注意的是:由于模型中所采用的细胞为人结肠癌细胞系(Caco-2细胞),Caco-2细胞经分化后类似小肠细胞并可表达成熟的小肠细胞的特征,进而该细胞被广泛用于吸收模型研究。推测卵白蛋白经过体外模拟胃肠道消化后,被Caco-2细胞吸收,在细胞内发挥保护作用,从而提高细胞存活率。并且,在未经H2O2处理、消化质量浓度为1mg/mL时,细胞存活率与对照组相比表现为既不升高也不降低,与对照组无显著性差异(P>0.05),表明消化产物对Caco-2细胞既没有毒性作用,也不促进细胞增殖。
相关链接:白蛋白,氨基酸,蛋白
声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系
| 大连医科大学附属第一医院 |
| 首都医科大学附属北京朝阳医院 |
| 四川大学华西医院 |
| 重庆医科大学附属第一医院 |
| 北京医院 |
| 中国医学科学院阜外医院 |
| 吉林大学第二医院 |
| 河南科技大学第一附属医院 |
| 山西医科大学第一医院 |
| 中山大学附属第一医院 |
| 承德医学院附属医院 |
| 山东省立医院 |
| 浙江大学医学院附属邵逸夫医院 |
| 天津医科大学总医院 |
| 海军军医大学附属长海医院 |
| 温州医学院附属第一医院 |
| 深圳市人民医院 |
| 空军军医大学西京医院 |
| 蚌埠医学院第一附属医院 |
| 深圳市第六人民医院(南山医院) |
| 上海交通大学医学院附属瑞金医院 |
| 青岛大学附属医院 |
| 北部战区总医院 |
| 济宁医学院附属医院 |
| 福建医科大学附属第一医院 |
| 烟台市烟台山医院 |
| 哈尔滨医科大学附属第二医院 |
| 昆明医科大学第一附属医院 |
| 山东淄博市第一医院 |
| 南京鼓楼医院 |
| 东莞市人民医院 |
| 新疆医科大学第一附属医院 |
| 北京京煤集团总医院 |
| 首都医科大学附属北京潞河医院 |
| 新疆维吾尔自治区人民医院 |
| 中南大学湘雅医院 |
| 广州医科大学附属第一医院 |
| 北京协和医院 |
| 江阴市人民医院 |
| 河北医科大学第二医院 |
| 中国人民解放军总医院第六医学中心 |
| 沈阳医学院附属中心医院(奉天医院) |
| 天津市宁河区医院 |
| 四川省人民医院 |
| 邯郸市第一医院 |
| 潍坊呼吸病医院 |
| 云南省第一人民医院 |
| 山西省人民医院 |
| 内蒙古医学院第三附属医院 |
| 河北衡水哈励逊国际和平医院 |
| 海南省人民医院 |
| 青海省人民医院 |
| 贵州省人民医院 |
| 华北理工大学附属医院 |
| 福建省泉州市第一医院 |
| 锦州医科大学附属第一医院 |
| 首都医科大学附属复兴医院 |
| 淄博市立医院 |
| 山西省太原市中心医院 |
| 上海市肺科医院 |
| 新疆医科大学第三附属医院 |
| 山西医学科学院山西大医院 |
| 天津市海河医院 |
| 战略支援部队特色医学中心 |
| 河北医科大学第三医院 |
| 北京积水潭医院 |
| 无锡市人民医院 |
| 新疆维吾尔自治区中医医院 |
| 安徽省胸科医院 |
| 空军军医大学唐都医院 |
| 广东省人民医院 |
| 复旦大学附属华山医院 |
| 首都医科大学附属北京安贞医院 |
| 中国人民解放军总医院第一医学中心 |
| 宁夏医科大学总医院 |
| 河南省焦作市第二人民医院 |
| 首都医科大学附属北京同仁医院 |
| 南方医科大学南方医院 |
| 南昌大学第二附属医院 |
| 北京市大兴区人民医院 |
| 上海交通大学医学院附属新华医院 |
| 内蒙古自治区人民医院 |
| 南昌大学第一附属医院 |
| 中国医科大学附属盛京医院 |
| 西安交通大学第一附属医院 |
| 河北医科大学第一医院 |
| 广西壮族自治区人民医院 |
| 北京市顺义区医院 |
| 复旦大学附属中山医院 |
| 中山大学附属第三医院 |
| 粤北人民医院 |
| 首都医科大学附属北京世纪坛医院 |
| 中国科学院大学附属北京怀柔医院 |
| 首都医科大学附属北京儿童医院 |
| 天津市第一中心医院 |
| 华中科技大学同济医学院附属同济医院 |
| 兰州大学第二附属医院 |
| 西藏自治区第二人民医院 |
| 唐山工人医院 |
| 中日友好医院 |
